- Es similar al concepto de porcentaje. El 1% sería una parte de 100 (102) mientras que 1 ppm sería un aparte de 106. La equivalencia entre porcentaje y ppm es la siguiente:
O
Ejemplos de uso: medida de concentraciones
El uso más habitual de ppm es en análisis químico para la medida de concentraciones muy diluidas.
- ppm en masa/masa
La concentración en partes por millón expresada en masa/masa se calcula dividiendo la masa del soluto (ms) entre la masa de la disolución (md, suma de la masa del soluto y la masa del disolvente), ambas expresadas en la misma unidad y multiplicadas por 106 (1 millón). Se suele nombrar como ppmm:
Por ejemplo, podemos expresar ambas masas en gramos. Si a 1500 g de agua le añadimos 0.01 g de un soluto:
Cppm = ( 0.01 / 1500.01 ) × 106 = 6.66 ppmm
Por tanto, una disolución de 0.01 g en 1500 g de disolvente tiene una concentración de 6.67 ppm. En el SI sería equivalente a una concentración de 6.66 mg/kg (1 ppm = 1 mg/kg).
Cómo la mayoría de las veces que se utilizan las partes por millón el soluto está muy diluido, es común que se desprecie en el denominador y simplemente se divida la masa del soluto entre la masa del disolvente.
Si no conocemos la masa de disolvente pero conocemos su volumen y su densidad, se puede calcular la masa como el volumen por la densidad, ya que la densidad (ρ, kg/m3 en el SI) es:
Recuerda que si el disolvente es agua, la densidad es prácticamente igual a 1 kg/L, lo que quiere decir que 1 L de agua tiene una masa aproximadamente igual 1 kg. Por tanto, si 1 ppm = mg/kg, en el caso del agua sería equivalente 1 mg/L.
- ppm en volumen/volumen
La expresión de una concentración en partes por millón volumen-volumen es similar a la expresión masa-masa. Se obtiene dividiendo el volumen de soluto (Vs) entre el el volumen de la disolución (Vd, volumen del soluto más el volumen del disolvente) y se multiplica por 106. Se suele nombrar como ppmv:
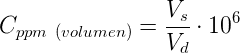
Por ejemplo, si disolvemos 1 ml de acetona en 2 L de agua (2 L = 2000 ml):
C(volumen/volumen) = ( 1 / 2001 ) x 106 = 499.75 ppmv
En el Sistema Internacional de Unidades sería equivalente a 499.75 μl/L (1 ppm = 1 μl/L), ya que un μl es una millonésima parte de 1 L.
Uno de los ejemplos más comunes del uso de partes por millón en volumen/volumen es paramedir concentraciones en el aire. Por ejemplo, en esta noticia se puede leer como la concentración media de CO2 en la atmósfera terrestre superó las 400 ppm. Esto quiere decir que cada litro de aire contiene 400 μl de CO2, o lo que es lo mismo, que el 0.04 % de la atmósfera es CO2 (recuerda que 1 ppm = 0.0001 %).
- ppm en masa/volumen
Muchas veces la concentración se expresa como masa de soluto en un determinado volumen de disolución. Las partes por millón en masa/volumen se calculan dividiendo la masa del soluto en gramos entre el volumen de disolución en mililitros y se multiplica por 106:

Qué sería equivalente a la masa del soluto en mg entre el volumen en litros:

En el caso del agua, o cualquier otro disolvente de densidad igual a 1 kg/L, sabemos que 1 kg tiene un volumen de 1 L. Para otros disolventes podemos obtener su volumen en litros si conocemos su masa y densidad. Por ejemplo, tenemos 0.5 mg de soluto y 0.2 kg de un disolvente de densidad de 0.95 kg/L. El volumen en litros del disolvente sería:
V = 0.2 / 0.95 = 0.21 L
Y la concentración en ppm masa/volumen sería:
C (masa/volumen) = 0.5 / 0.21 = 2.38 ppm
Relación con otras partes por notación
| Nombre | Notación | Coeficiente |
|---|---|---|
| Por ciento | % | 10-2 |
| Por mil | ‰ | 10-3 |
| Partes por millón | ppm | 10-6 |
| Partes por billón | ppb | 10-9 |
| Partes por trillón | ppt | 10-12 |
- cuando trabajamos con los valores de los contaminantes en agua o en aire, condisoluciones de muy bajas concentraciones o con la cantidad de partículas de polvo en un ambiente, entre otros.

No hay comentarios:
Publicar un comentario